Von Jon Fleetwood
Beta-Propiolacton wird von den US-Behörden als Karzinogen der Gruppe 2B eingestuft und in Europa als Karzinogen der Gruppe 1B.
Die Chemikalie, die in der neuen Vogelgrippe-Impfstoffplattform „Generation Gold Standard“ der Trump-Regierung verwendet wird – Beta-Propiolacton (BPL) – wird von den US-Behörden als Karzinogen der „Gruppe 2B“ eingestuft (was bedeutet, dass die Substanz möglicherweise beim Menschen Krebs verursacht) und in Europa als Karzinogen der „Gruppe 1B“ (was bedeutet, dass sie vermutlich beim Menschen Krebs verursacht).
Ein Karzinogen ist jeder Stoff oder Wirkstoff, der Krebs verursachen kann, indem er die DNA einer Zelle schädigt und zu unkontrolliertem Zellwachstum führt.
Diese Enthüllung folgt auf einen Bericht dieser Website, wonach das US-amerikanische National Institute of Allergy and Infectious Diseases (NIAID) unter der Leitung von Dr. Jeffery Taubenberger die Entwicklung chimärer, im Labor hergestellter Vogelgrippeviren in amerikanischen und ausländischen Labors finanziert hat, obwohl Taubenberger selbst in einem Bundespatent für genau die BPL-basierte Vogelgrippe-Impfstoffplattform genannt wird, die durch diese Experimente gerechtfertigt werden soll.
In einer Pressemitteilung der Regierung vom Mai 2025 wurde angekündigt, dass die mehrere hundert Millionen Dollar teure BPL-Plattform zur Herstellung von Impfstoffen gegen eine Vogelgrippe-Pandemie eingesetzt werden soll:
Das US-Gesundheitsministerium (HHS) und die National Institutes for Health (NIH) gaben heute die Entwicklung einer universellen Impfstoffplattform der nächsten Generation namens „Generation Gold Standard“ bekannt, die auf einer mit Beta-Propiolacton (BPL) inaktivierten Ganzvirusplattform basiert.
Diese Initiative stellt einen entscheidenden Schritt in Richtung Transparenz, Effektivität und umfassender Vorsorge dar und finanziert die interne Entwicklung universeller Influenza- und Coronavirus-Impfstoffe durch die NIH, darunter die Kandidaten BPL-1357 und BPL-24910. Diese Impfstoffe sollen einen breit gefächerten Schutz gegen mehrere Stämme pandemieanfälliger Viren wie die Vogelgrippe H5N1 und Coronaviren wie SARS-CoV-2, SARS-CoV-1 und MERS-CoV bieten.
Einstufung durch die USA, die UNO, die WHO und die IARC als „Gruppe 2B“: Möglicherweise krebserregend für den Menschen
Seit 1974 ist der Internationalen Agentur für Krebsforschung (IARC), einer zwischenstaatlichen Einrichtung der Weltgesundheitsorganisation (WHO) der Vereinten Nationen (UNO), die sich mit der Erforschung der Ursachen von Krebs befasst, bekannt, dass BPL bei Säugetieren Krebs verursacht.
Laut IARC-Dokumenten „wurde β-Propiolacton auf Karzinogenität bei Mäusen nach Hautapplikation oder subkutaner oder intraperitonealer Injektion und bei Ratten nach subkutaner Injektion getestet, wobei lokale Tumore auftraten. Es ist nach einmaliger Exposition für Mäuse karzinogen. Die orale Verabreichung an Ratten ergab Hinweise auf karzinogene Aktivität. Die bei syrischen Hamstern und Meerschweinchen erzielten Ergebnisse sind nicht eindeutig (IARC, 1974).“

Eine im Februar 2020 in ACS Publications, dem Verlag der American Chemical Society (ACS), veröffentlichte, von Fachkollegen begutachtete Studie bestätigt, dass BPL beim Menschen wahrscheinlich krebserregend ist und bei Tieren zum Tod führt.
„Die direkte Exposition gegenüber BPL führt neben einer wahrscheinlichen Karzinogenität zu schweren Reizungen mehrerer Systeme, darunter Hautverbrennungen und dauerhafte Schäden an Augen, Leber und Nieren. Selbst bei einer einzigen verabreichten Dosis zeigt sich BPL bei Versuchstieren als hochgradig tumorigen, genotoxisch und karzinogen. Bei höheren Dosen führt es sogar zum Tod“, heißt es in der Studie.
Die US-amerikanischen Zentren für Krankheitskontrolle und Prävention (CDC) bestätigen, dass BPL ein „potenzielles berufsbedingtes Karzinogen” ist, da die Verbindung bei Tieren „Tumore der Leber, Haut und des Magens” verursacht.
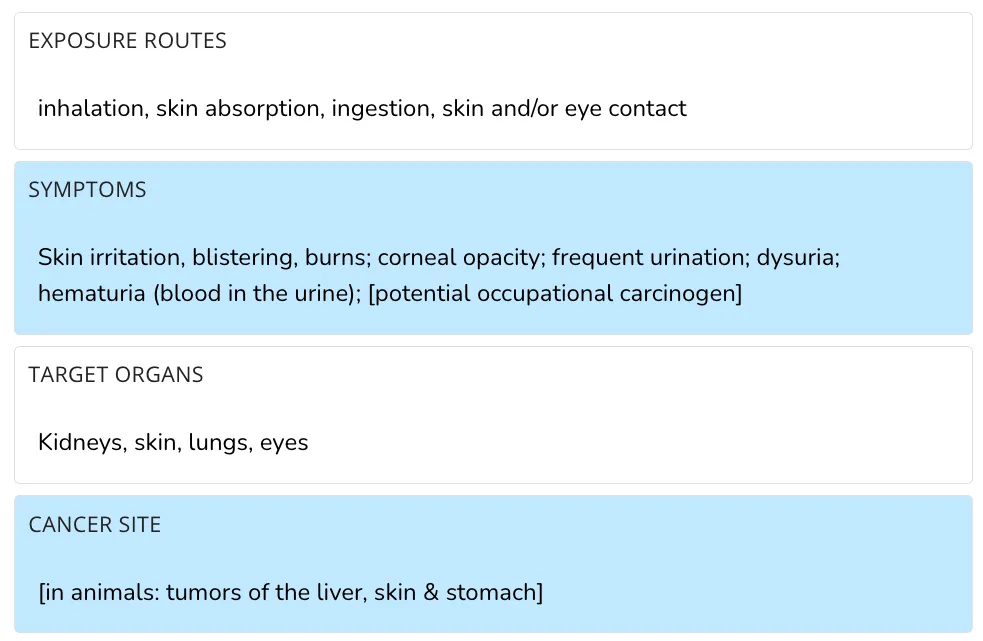
Dokumente der US-Umweltschutzbehörde (EPA), einer unabhängigen Bundesbehörde, die für den Schutz der menschlichen Gesundheit und der Umwelt zuständig ist, bestätigen, dass BPL von der IARC „als Gruppe 2B, möglicherweise krebserregend für den Menschen“ eingestuft wird.

Das Gesundheits- und Seniorenministerium von New Jersey bestätigt außerdem Folgendes in Bezug auf BPL:
- „sollte wie ein Karzinogen behandelt werden – mit äußerster Vorsicht“;
- „steht auf der Liste der besonders gesundheitsgefährdenden Stoffe, da es karzinogen, mutagen und ätzend ist“;
- „es gibt möglicherweise keine sichere Expositionsgrenze für ein Karzinogen, daher sollte der Kontakt so weit wie möglich reduziert werden“;
- „kann beim Menschen karzinogen sein, da es bei Tieren Haut- und Magenkrebs verursacht“;
- „Viele Wissenschaftler glauben, dass es keine sichere Expositionsgrenze für Karzinogene gibt. Solche Stoffe können auch das Potenzial haben, beim Menschen Fortpflanzungsschäden zu verursachen.“
- „Die meisten Wissenschaftler sind sich einig, dass eine Chemikalie, die bei Tieren Krebs verursacht, als mutmaßliches Humankarzinogen behandelt werden sollte, sofern nicht das Gegenteil bewiesen ist.“

Das Nationale Toxikologieprogramm (NTP) des US-Gesundheitsministeriums (HHS) bestätigt ebenfalls, dass BPL „aufgrund ausreichender Hinweise auf Karzinogenität aus Studien an Versuchstieren vernünftigerweise als krebserregend für den Menschen anzusehen ist“.

Die Arbeitsschutzbehörde (OSHA) des US-Arbeitsministeriums bestätigt (hier), dass BPL „als potenzielles Karzinogen am Arbeitsplatz identifiziert wurde“.

Europäische Einstufung „Gruppe 1B“: Vermutlich krebserregend für den Menschen
Die Europäische Chemikalienagentur (ECHA) stuft (hier) BPL in die gefährlichere Karzinogeneinstufung Gruppe 1B ein, wobei ein Stoff nicht nur als möglicherweise krebserregend für den Menschen angesehen wird, sondern als „vermutlich“ krebserregend für den Menschen eingestuft wird.
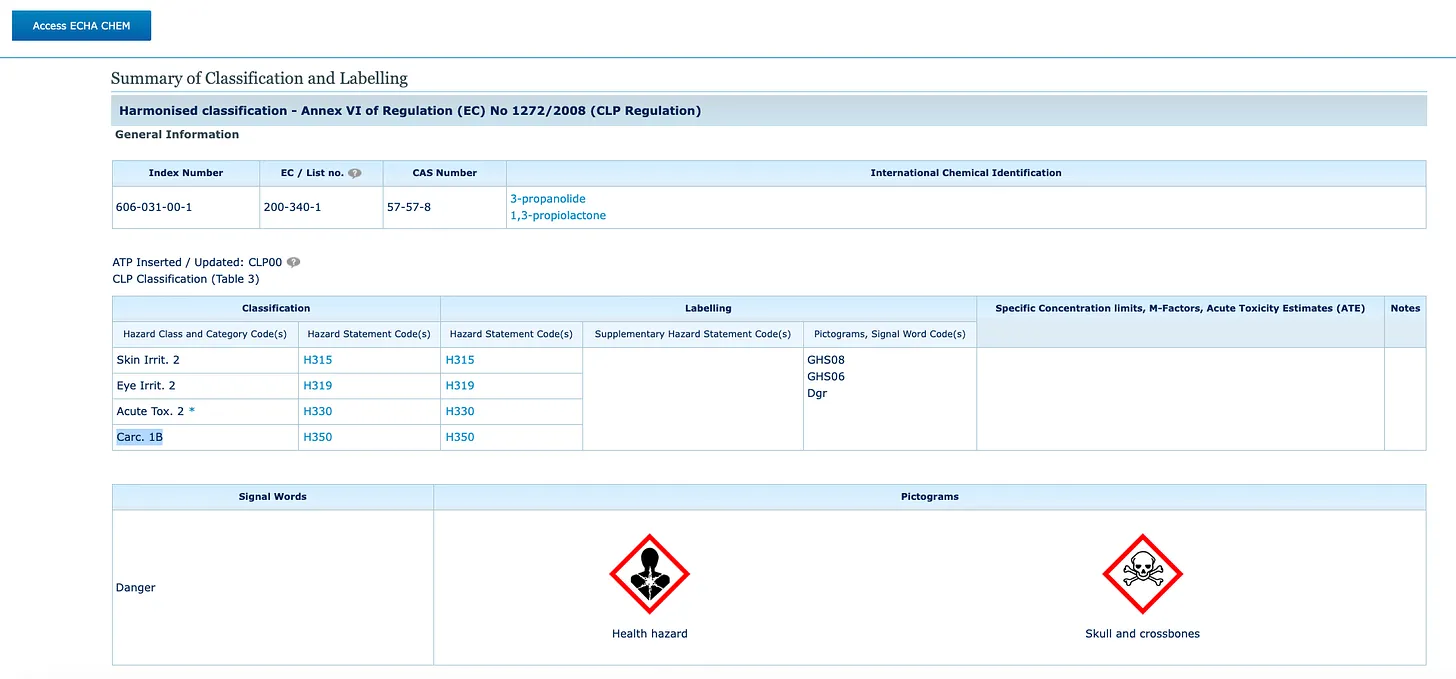

Sicherheitsdatenblätter europäischer Chemiehersteller bestätigen die Einstufung von BPL als Karzinogen der Kategorie 1B und erfordern sogar eine Tabelle mit Totenkopf und gekreuzten Knochen.

Selbst „spurartige“ Mengen von BPL sind gefährlich – aber Impfstoffe enthalten nachweisbare Mengen
Eine Veröffentlichung vom Oktober 2025 in der Fachzeitschrift Analytical Methods, herausgegeben von der britischen Royal Society of Chemistry, bestätigt, dass selbst Restmengen von BPL in Impfstoffampullen „inakzeptabel“ sind.
Die Autoren warnen ausdrücklich, dass es „notwendig ist, alle nach dem Inaktivierungsprozess verbleibenden Spuren von BPL zu beseitigen, um die Sicherheit der Impfstoffe zu gewährleisten“.
„Eine der am häufigsten verwendeten Techniken zur Herstellung von Impfstoffen ist die Virusinaktivierung“, heißt es in der Studie. „β-Propiolacton (BPL) ist ein Wirkstoff, der zur Inaktivierung und Sterilisierung biologischer Produkte, einschließlich Impfstoffen, verwendet wird. BPL wird wegen seiner Fähigkeit bevorzugt, Viruskapsidproteine zu konservieren und eine hohe Immunogenität aufrechtzuerhalten. Allerdings ist BPL ein Alkylierungsmittel mit potenziell karzinogenen Eigenschaften, weshalb es nicht akzeptabel ist, dass Restmengen im endgültigen Impfstoffprodukt vorhanden sind. Daher ist es notwendig, alle nach dem Inaktivierungsprozess verbleibenden Spuren von BPL zu beseitigen, um die Sicherheit des Impfstoffs zu gewährleisten.“

Eine im August 2024 in der Fachzeitschrift Journal of Chromatography B veröffentlichte Studie bestätigt, dass aufgrund der Karzinogenität von BPL „dessen Rückstände in Impfstoffen vollständig hydrolysiert werden sollten, um Zytotoxizität zu vermeiden“.
Wie in der Veröffentlichung von Analytical Methods vom Oktober 2025 bedeutet dies, dass BPL vollständig chemisch abgebaut werden muss, bevor der Impfstoff sicher ist.

Allerdings enthalten Impfstoffe, die BPL verwenden, Spuren der krebserregenden Verbindung.
Beispielsweise bestätigt ein Dokument der FDA für den Imovax®-Tollwutimpfstoff von Sanofi Pasteur SA, dass BPL in der endgültigen Ampulle „vorhanden ist”, bevor diese den Patienten injiziert wird.
„Der von Sanofi Pasteur SA hergestellte Imovax®-Tollwutimpfstoff ist eine sterile, stabile, gefriergetrocknete Suspension des Tollwutvirus, die aus dem Stamm PM-1503-3M des Wistar Institute in Philadelphia, PA, hergestellt wurde“, heißt es in der Packungsbeilage.
„Das Virus wird aus infizierten menschlichen diploiden Zellen des Stammes MRC-5 gewonnen, durch Ultrafiltration konzentriert und mit Beta-Propiolacton inaktiviert. Eine Dosis des rekonstituierten Impfstoffs enthält weniger als 100 mg Humanalbumin, weniger als 150 mcg Neomycinsulfat und 20 mcg Phenolrot-Indikator. Beta-Propiolacton, ein Restbestandteil des Herstellungsprozesses, ist in einer Konzentration von weniger als 50 ppm vorhanden.“

Informationsblätter der kanadischen Regierung zu Imovax bestätigen, dass Störungen des Immunsystems im Zusammenhang mit dem Impfstoff „möglicherweise mit dem Vorhandensein von durch Betapropiolacton verändertem Humanalbumin im Human Diploid Cell Rabies-Impfstoff (HDCV) zusammenhängen könnten”.

Fazit
Die neue Impfstoffplattform „Generation Gold Standard“ der US-Bundesregierung basiert auf einer Chemikalie, die nach übereinstimmender Meinung der Aufsichtsbehörden in den USA, Europa und der UN Krebs verursachen kann.
Beta-Propiolacton (BPL) ist kein Randthema.
Es handelt sich um ein bekanntes Karzinogen, das bei mehreren Tierarten Tumore hervorruft und von US-Behörden offiziell als mögliches Humankarzinogen der Gruppe 2B und in Europa als vermutetes Humankarzinogen der Gruppe 1B eingestuft wird.
Selbst Spuren von BPL gelten nach peer-reviewten toxikologischen Standards in fertigen Impfstoffen als „inakzeptabel“.
Dennoch bestätigen von der FDA zugelassene Produkte wie der Imovax®-Tollwutimpfstoff von Sanofi dessen nachweisbare Präsenz.
Das bedeutet, dass dieselben Bundesbehörden, die neue Pandemie-Erreger und Impfstoffe entwickeln, die Injektion einer Substanz genehmigen, die seit langem als krebserregend, genotoxisch und organisch schädigend bekannt ist.
Kurz gesagt, die Flaggschiff-Plattform der US-Regierung für „Next-Generation”-Vogelgrippe-Impfstoffe basiert auf einer Chemikalie, die nach den Definitionen ihrer eigenen Behörden niemals in den menschlichen Körper gelangen sollte.